外围电子和价电子区别高中化学
概念不同:外围电子是指原子核外最高能级组上的电子;价电子是指原子核外能与其它原子形成化学键的电子 。范围不同:外围电子包括成键电子和非成键电子;主族元素的价电子就是主族元素原子的最外层电子,过渡元素的价电子不仅是最外层电子,还有次外层电子,某些元素的倒数第三层电子也可成为价电子等 。排布式不同:外围电子排布式是指将过渡元素原子的电子排布式中符合稀有气体的原子的电子排布的部分或主族、0族元素的内层电子排布省略后剩下的式子;价电子排布式认为是能参与成键的电子的排布式 。【外围电子和价电子区别高中化学】
文章插图
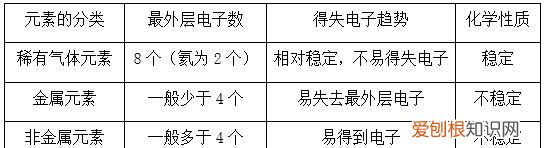
原子价电子排布式和电子排布式有什么区别分别是什么意思基态原子外围电子排布式和价电子排布式没有什么不同 。外围电子排布式:是指将过渡元素原子的电子排布式中符合稀有气体的原子的电子排布的部分(原子实)或主族、0族元素的内层电子排布省略后剩下的式子 。如Cl:1s2 2s2 2p6 3s2 3p5将"1s2 2s2 2p6"(Cl的内层电子排布,也是Ne的电子排布式)省略,"3s2 3p5"即为氯原子的外围电子排布式 。同理,K原子的外围电子排布式为4s1(省略了内层电子排布1s2 2s2 2p6 3s2 3p6)、Fe原子外围电子排布式为3d6 4s2(省略了Ar的电子排布式1s2 2s2 2p6 3s2 3p6) 。价电子是原子在参与化学反应时能够用于成键的电子,是原子核外跟元素化合价有关的电子 。在主族元素中,价电子数就是最外层电子数 。副族元素原子的价电子,除最外层电子外,还可包括次外层电子 。
推荐阅读
- 摩羯座明星与什么星座配对 摩羯座到底和谁配
- 射手座明星跟什么星座配对 和射手座最配的星座是
- 十二星座分手后的表现 分手后就不要去挽留这些星座了
- 冬至扫墓买什么贡品 不同对象贡品都不一
- 大蒜杆子的功效与作用
- 甲午年是哪一年 甲午年是指哪一年
- 香水有什么危害吗
- 罗马的发源地
- 橙子橘子桔子柑子的区别