文章插图
现代仪器
1. 核磁共振仪:碳氢化合物中处于相同生物化学自然环境的氢氢原子类型;
2. 红外光谱分析:主要就测量碳氢化合物中阴离子的类型;
3. 紫外光谱分析:碳氢化合物中的共轭结构(主要就指双键);
4. 质谱:碳氢化合物的相对大分子质量,对测量结构也有一定的帮助;
5. 氢原子吸收(发射)光谱分析:测量生物化学物质的的碱金属,也可测量非碱金属;
6. 分光质谱仪:测量溶液中生物化学物质的成份以浓度,重点是测反应速率;
7. 色谱检测仪:利用相同生物化学物质在固定相和流动相中分配比的相同,对生物化学物质进行分离,主要就分类物理性质和生物化学性质相近的生物化学物质,纸色谱法就是其中的一种;
8. 奥斯特瓦尔德熔化法:测量碳氢化合物中C、H、O、N、Cl的有无及浓度,CO2、H2O、N2、HCl;
9. 型材熔化法:测量碳氢化合物中与否含硫,火焰为绿色说明所含硫;
10. 钠熔法:测量碳氢化合物与否所含X、N、S,NaX、Na2S、NaCN;
11. 原素检测仪:测量生物化学物质中原素的类型;
12. 扫面隧道显微镜:观察、操纵生物化学物质表面的氢原子和大分子;
02
生物化学史
1. 惠勒:明确提出氢原子学说;
2. 尖萼:在光电效应试验基础上明确提出“洋葱面包式”数学模型;
3. 卢瑟福:在α粒子散射试验基础上明确提出“核+电子”数学模型;
4. 波尔:在量子力学基础上明确提出轨道数学模型;
5. 荣格:发现氯气;
6. 曼恩:人工制备尿素;
7. 齐奥尔科夫斯基:原素周期表;
03
金属材料及成份
1. 火棉:水溶性与乙酸完全缩合的乙醛;
2. 胶棉:水溶性与乙酸不完全缩合的乙醛;
3. 仿生丝、仿生毛、仿生棉、黏胶纤维、铜氨纤维主要就成份都是水溶性;
4. 醇酸树脂:水溶性与醋丙酮缩合后的乙醛;
5. 讷伊县:成份为SiO2,镜面反射原理;
6. Al2O3:仿生萤石、红宝石、蓝宝石的主要就成份;
7. SiO2:硅石、地板、石英、玛瑙、缆线的主要就成份;
8. 硅酸盐:石材、陶器、瓷器、琉璃的主要就成份;
9. 新式无机物金属金属材料:氧化铝陶瓷器、碳化硅陶瓷器、缩聚反应陶瓷器、缆线等;
具有耐高温、强度大的优点,还具有电学优点、光学优点、生物功能;
10. 传统无机物金属金属材料:石材、地板、陶瓷器;
11. 新式电化学金属材料:电化学膜、系上、隐形眼镜、仿生关节、心脏蜻鲶、液晶金属材料等;
12. 五大制备金属材料:制备塑料、制备纤维、制备橡胶;
04
能源问题
1. 天然气:烷烃、直链、芳烃的混合物
天然气的分馏法是化学平衡,天然气的丙醇、裂解都是生物化学作用
2. 煤:主要就成份是碳
煤的电炉、气化、液化都是生物化学作用;
3. 生生物化学物质能:通过光合作用,光伏以生物化学能的形式贮藏在生生物化学物质中的能量形式;
木材、森林废物、农业废物、植物、动物粪便、沼气等;
4. 新能源:光伏、风能、水力、巴祖、核能;
05
自然环境问题与食品安全
1. 臭氧层空洞:制冷剂进入对流层导致臭氧减少;
2. 酸雨:大气中CO2、CH4增多,造成全球平均气温上升;
3. 光生物化学烟雾:NxOy在紫外线作用下发生一系列的光生物化学反应而生成的烟雾;
4. 蓝藻:海水水污染;
5. 水华:淡水水污染;
6. 酸雨:pH<5.6;
7. 室内污染:HCHO、苯、放射性氡、电磁辐射;
8. PM2.5:直径≤2.5μm(2.5×10-6m)能在空中长时间悬浮,颗粒小,表面积大,能吸附大量有害有毒生物化学物质(如金属、微生物);
雾霾天气的形成于部分颗粒在空气中形成气溶胶有关9. 非法食品添加剂:吊白块、苏丹红、三聚氰胺、硼酸、荧光增白剂、瘦肉精、工业明胶;
10. 腌制食品:腌制过程中会产生亚乙酸盐,具有致癌性;
11. 地沟油:地沟油中有黄曲霉素,具有致癌性;可以制肥皂盒生物柴油;
12. 绿色生物化学:绿色生物化学是指生物化学反应及其过程以“氢原子经济性”为基本原则,即在获取新生物化学物质的生物化学反应中充分利用参与反应的每个原料氢原子,实现“零排放” 。绿色生物化学的目标是研究和寻找能充分利用的无毒害原料,最大限度地节约能源,在化工生产的各环节都实现净化和无污染的反应途径;
06
糖 类
1. 单糖:
丙糖:甘油醛(最简单的糖)CH2(OH)CH(OH)CHO
戊糖:核糖、脱氧核糖;
己糖:葡萄糖、半乳糖、果糖;
2. 二糖:
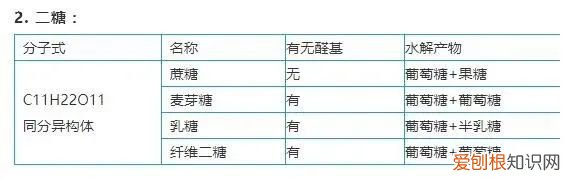
文章插图
3. 多糖:
①淀粉(C6H10O5)n和水溶性(C6H10O5)n,n值是一个区间,故两者不是同分异构体,都是混合物;
②判断淀粉水解程度的方法 (在酸性条件下水解)
a.尚未水解:必须先加NaOH中和硫酸,再加入新制氢氧化铜加热,无砖红色沉淀;
b.完全水解:加入碘水,不呈蓝色
c.取两份,一份加入碘水呈蓝色;一份加入NaoH中中和硫酸后,再加入新制氢氧化铜加热,有砖红色沉淀
③人体中无水溶性酶,不能消化水溶性,多吃含水溶性食物可促进肠道蠕动;
07
氨基酸和蛋白质
1. α-氨基酸:氨基和羧基连在同一个碳上天然蛋白质水解生成的氨基酸都是.α-氨基酸;
2. 两性:-NH2具有碱性,-COOH具有酸性
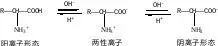
文章插图
固体氨基酸主要就以内盐形式存在,所以具有较高的熔沸点,且难溶于有机溶剂;
两个相同的氨基酸缩合形成二肽,有四种相同的乙醛(两个自身,两个交叉);
3. 分离:当氨基酸以两性离子存在于溶液中时,其溶解度最小,而相同的氨基酸出现这种情况的pH各不相同,故可利用此差异,通过调节溶液的pH值来分离氨基酸;
4. 盐析:许多蛋白质在水中有一定的溶解度,溶于水形成胶体;
在浓度较高的低盐金属盐(Na2SO4)或铵盐中,能破坏胶体结构而使蛋白质溶解度降低,从而使蛋白质变成沉淀析出,析出的蛋白质仍具有生物活性;
5. 变质:
①重金属盐、强酸、强碱、甲醛、酒精等可使蛋白质变性而失去活性,析出的蛋白质不再溶于水;
②当人体误食重金属盐时,可喝大量的牛奶、豆奶、鸡蛋清来解毒;
③酒精消毒是破坏了病毒的蛋白质活性而杀死病毒;
6. 颜色反应:
①蛋白质遇双缩脲试剂呈玫瑰紫色;
②含双键的蛋白质与浓乙酸作用生成黄色生物化学物质;
③氨基酸遇茚三酮呈紫色;
7. 氢键存在:
①蛋白质的二级结构;
②DNA双螺旋结构,AT之间两条,CG之间三条;
08
油 脂
1. 油脂不是电化学,是由高级脂肪酸与甘油形成的酯类;
2. 油:不饱和脂肪酸甘油酯,常温液态,如豆油、花生油;能使溴水退色;不能从溴水中萃取溴单质;
3. 脂肪:饱和脂肪酸甘油酯,常温固态,如猪油、牛油油;
4. 皂化反应:油脂与碱反应生成甘油与高级脂肪酸钠;
5. 油脂硬化:不饱和高级脂肪酸甘油酯与氢气反应生成饱和高级脂肪酸甘油酯
6. 油脂和矿物油不是同一生物化学物质,矿物油是烃类;
7. 天然的油脂都是混合物;
8. 硬水中有较多的Mg2+、Ca2+,会生成不溶于水的(C17H35COO)2Mg和(C17H35COO)2Ca,使肥皂的消耗量增加,故不宜在硬水中使用肥皂;
9. 不饱和脂肪酸甘油酯中的双键会被空气氧化而变质;
10. 地沟油和仿生奶油都是油脂;
09
生物化学中的不一定
1. 氢原子核不一定都是由质子和中子构成的 。如氢的同位素(11H)中只有一个质子 。
2. 酸性氧化物不一定都是非金属氧化物 。如Mn2O7是HMnO4的丙酮,是金属氧化物 。
3. 非金属氧化物不一定都是酸性氧化物 。如CO、NO都不能与碱反应,是不成盐氧化物 。
4. 金属氧化物不一定都是碱性氧化物 。如Mn2O7是酸性氧化物,Al2O3是两性氧化物 。
5. 电离出的阳离子都是氢离子的不一定是酸 。如苯酚电离出的阳离子都是氢离子,属酚类,不属于酸 。
6. 由同种原素组成的生物化学物质不一定是单质 。如金刚石与石墨均由碳原素组成,二者混合所得的生物化学物质是混合物;由同种原素组成的纯净物是单质 。
7. 晶体中所含阳离子不一定所含阴离子 。如金属晶体中所含金属阳离子和自由电子,而无阴离子 。
8. 有单质参加或生成的生物化学反应不一定是氧化还原反应 。如金刚石→石墨,同素异形体间的转化因反应前后均为单质,原素的化合价没有变化,是非氧化还原反应 。
9. 离子化合物中不一定所含金属离子 。如NH4Cl属于离子化合物,其中不含金属离子 。
10. 与水反应生成酸的氧化物不一定是丙酮,与水反应生成碱的氧化物不一定是碱性氧化物 。如NO2能与水反应生成酸—乙酸,但不是乙酸的丙酮,乙酸的丙酮是N2O5,Na2O2能与水反应生成碱—NaOH,但它不属于碱性氧化物,是过氧化物 。
11. pH=7的溶液不一定是中性溶液 。只有在常温时水的离子积是1×10-14,此时pH=7的溶液才是中性 。
12. 用pH试纸测溶液的pH时,试纸用蒸馏水湿润,测得溶液的pH不一定有误差 。
13. 大分子晶体中不一定所含共价键 。如稀有气体在固态时均为大分子晶体,不含共价键 。
14. 能使品红溶液褪色的气体不一定是SO2,如Cl2、O3均能使品红溶液褪色 。
15. 金属阳离子被还原不一定得到金属单质 。如Fe3+可被还原为Fe2+ 。
16. 某原素由化合态变为游离态时,该原素不一定被还原 。如2H2O=2H2↑+O2↑,氢原素被还原而氧原素被氧化 。
17. 强氧化物与强还原剂不一定能发生氧化还原反应 。如浓硫酸是常见的强氧化剂,氢气是常见的还原剂,但可用浓硫酸干燥氢气,因二者不发生反应 。
18. 放热反应在常温下不一定很容易发生,吸热反应在常温下不一定不能发生 。如碳与氧气的反应为放热反应,但须点燃;Ba(OH)2·8H2O与NH4Cl反应为吸热反应,但在常温下很容易发生 。
19. 含碱金属的离子不一定都是阳离子 。如AlO2-、MnO4- 。
20. 最外层电子数大于4的原素不一定是非碱金属 。如周期表中ⅣA、ⅤA、ⅥA中的碱金属最外层电子数均多于4个 。
21. 不能在强酸性溶液中大量存在的离子,不一定能在强碱性溶液中大量存在 。如HCO3-、HS-等离子既不能在强酸性溶液中大量存在,也不能在强碱性溶液中大量存在 。
22. 组成和结构相似的生物化学物质,相对大分子质量越大,熔沸点不一定越高 。一般情况下该结论是正确的,但因H2O、HF、NH3等大分子间能形成氢键,熔沸点均比同主族原素的氢化物高 。
23. 只由非碱金属组成的晶体不一定属于大分子晶体 。如NH4Cl属于离子晶体 。
24. 只所含极性键的大分子不一定是极性大分子 。如CCl4、CO2等都是所含极性键的非极性大分子 。
25. 铁与强氧化性酸反应不一定生成三价铁的化合物 。铁与浓硫酸、乙酸等反应,若铁过量则生成亚铁离子 。
26. 强电解质不一定导电;一般强电解质的晶体不导电;
27. 强电解质的导电性不一定强于弱电解质;与溶度有关;
【高中必须掌握的化学基础知识是什么,高中化学:95个常识性基础知识点整理汇总,建议家长为孩子收藏】28. 失去电子难的氢原子获得电子的能力不一定强 。如稀有气体氢原子既不易失去电子也不易得到电子 。
推荐阅读
- 生活中实用的知识,5个超级实用的生活常识,可能颠覆你的认知!
- 用破壁机怎么榨果汁
- 培养自信孩子的4种方法是,培养自信孩子的4种方法
- 商品砼外加剂有几种
- 高中化学知识常识,高中化学有哪些很实用的化学常识?
- 暖气炉什么牌子好,暖气炉能带几平方
- 家长如何培养孩子的专注能力的主题活动,培养孩子专注力,家长可以从这3个方面入手
- 取火车票步骤
- 要考北京电影学院需要哪些准备